BCAS 免稀释 BCA 蛋白定量试剂盒(增强型)
规格:500T/盒
免稀释 BCA 蛋白定量试剂盒(增强型)使用说明书
预制 8 个梯度浓度标准品
562, 595 和 600 nm 波长测定
酶标仪和分光光度计通用
室温保存
试剂盒提供的试剂:
1. 试剂 A,两瓶,2 x 50 mL,室温保存;
2. 试剂 B,两管,2 x 2 mL,室温保存;
3. 蛋白标准品(预先配制的八个不同梯度浓度),固体,8 管,8 x 1 mL,室温保存。
|
标准品管号
|
①
|
②
|
③
|
④
|
⑤
|
⑥
|
⑦
|
⑧
|
|
标准品浓度
(mg/mL)
|
2 | 1.5 | 1 | 0.75 | 0.5 | 0.25 | 0.125 | 0 |
检测仪器:酶标仪或分光光度计,500-600 nm,最佳波长 562 nm,可选波长 595, 600 nm。
用途:本试剂盒适用定量检测液体样本中的蛋白浓度。可以用酶标板在酶标仪上检测,和 用比色皿在分光光度计上检测。
检测范围:0.125-2 mg/mL
检测原理:蛋白质在碱性条件 下将二价铜离子还原为一价 铜离子,一价铜离子与双喹啉 甲酸(BCA)分子形成紫色络 合物,光吸收(OD)的峰值
在 562 nm 波长。光吸收值和 蛋白浓度在检测范围内具有 线性关系。

蛋白标准品溶液的配制和保存:
取 8 管蛋白标准品(BSA 干粉),每管加 1 mL 纯水,溶 解混匀即可。固体标准品可室温保存;配成液体后,短期 4°C 保存,长期可分装-20℃保 存。
工作液的配制:
1. 按 50:1 的体积比,将试剂 A 与试剂 B 混匀,现配现用。比如:2 mL 试剂 A 中,加 入 40 µL 试剂 B。工作液可以于室温保存一周,不用避光。
2. 样本液用量与工作液用量的比值是 1:10 或 1:20。用 96 孔酶标板测试时,每孔用量是 20 μL 样本液和 200 μL 工作液,比值是 1:10。用微量比色皿测试时,每个比色皿用 量是 50 μL 样本液和 1 mL 工作液,比值是 1:20。
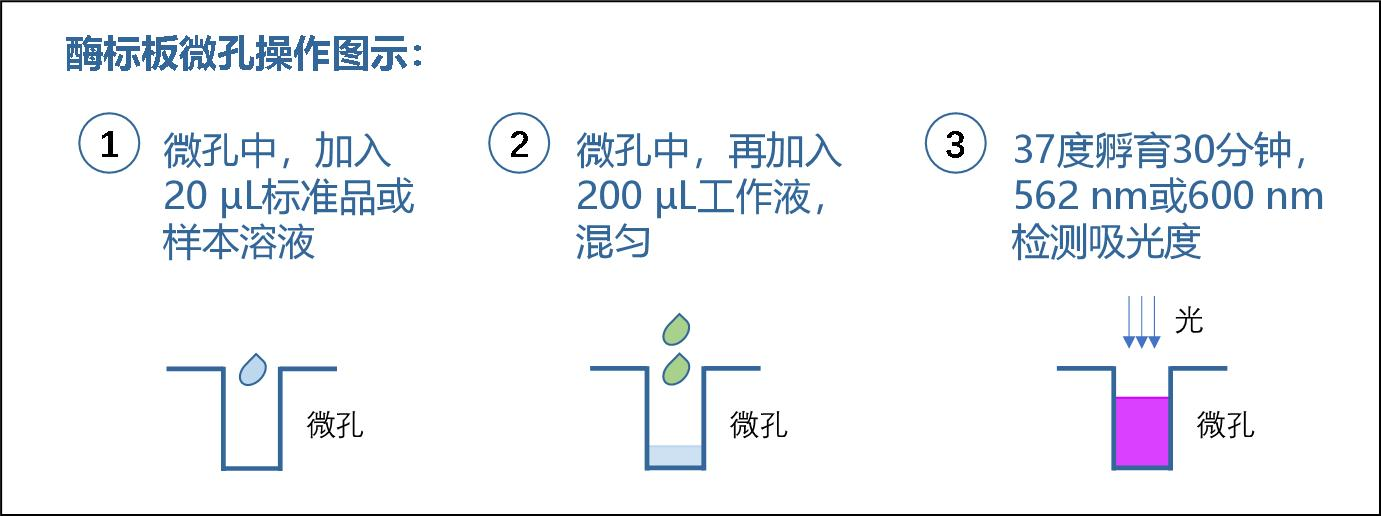
酶标板微孔(200 μL)测试操作步骤:
1. 标准孔:取 20 μL 不同浓度的标准品, 加入到对应的标准孔中。
2. 样本孔:取 20 μL 的待测样本,加入到 对应的样本孔中。为准确定量,建议(1) 样本根据经验估计,稀释到检测范围内(0.125-2 mg/mL)的浓度检测;(2)样本也 按标准品的方法梯度稀释后,多点测试。
3. 向标准孔和样本孔加入 200 μL 的工作液,混匀。
4. 盖上酶标板盖,37℃静置孵育 30 分钟,冷却到室温。
5. 用酶标仪测定光吸收值(OD 值),最佳选用 562 nm,也可以选用 500-600 nm 范围 内的其他波长,如 595 或 600 nm。
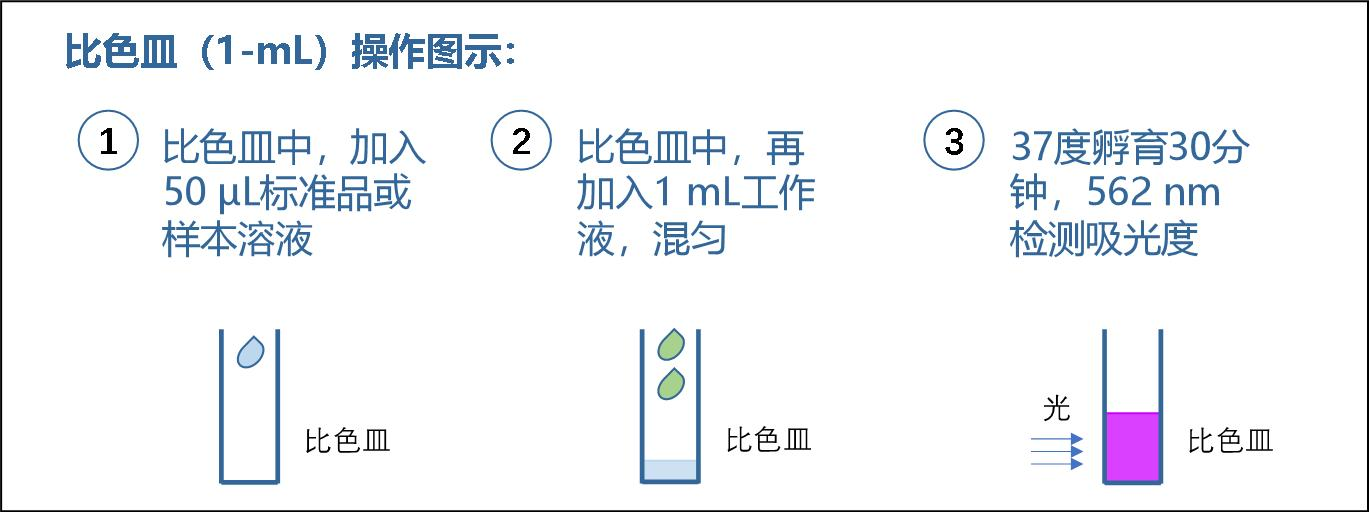
比色皿(1 mL)测试操作步骤:
1. 标准管:取 50 μL 不同浓度的标准品, 加入到对应的标准管(可以用 1.5-mL 离 心管)中。
2. 样本管:取 50 μL 的待测样本,加入到对应的样本管(可以用 1.5-mL 离心管)中。 为准确定量,建议(1)样本根据经验估计,稀释到检测范围内(0.125-2 mg/mL) 的浓度检测;(2)样本也按标准品的方法梯度稀释后,多点测试。
3. 向标准管和样本管加入 1 mL 的工作液,混匀。
4. 37℃静置孵育 30 分钟,冷却到室温。
5. 转移液体到比色皿中,用分光光度计测定光吸收值(OD 值),最佳选用 562 nm,也 可以选用 500-600 nm 范围内的其他波长,如 595 或 600 nm。
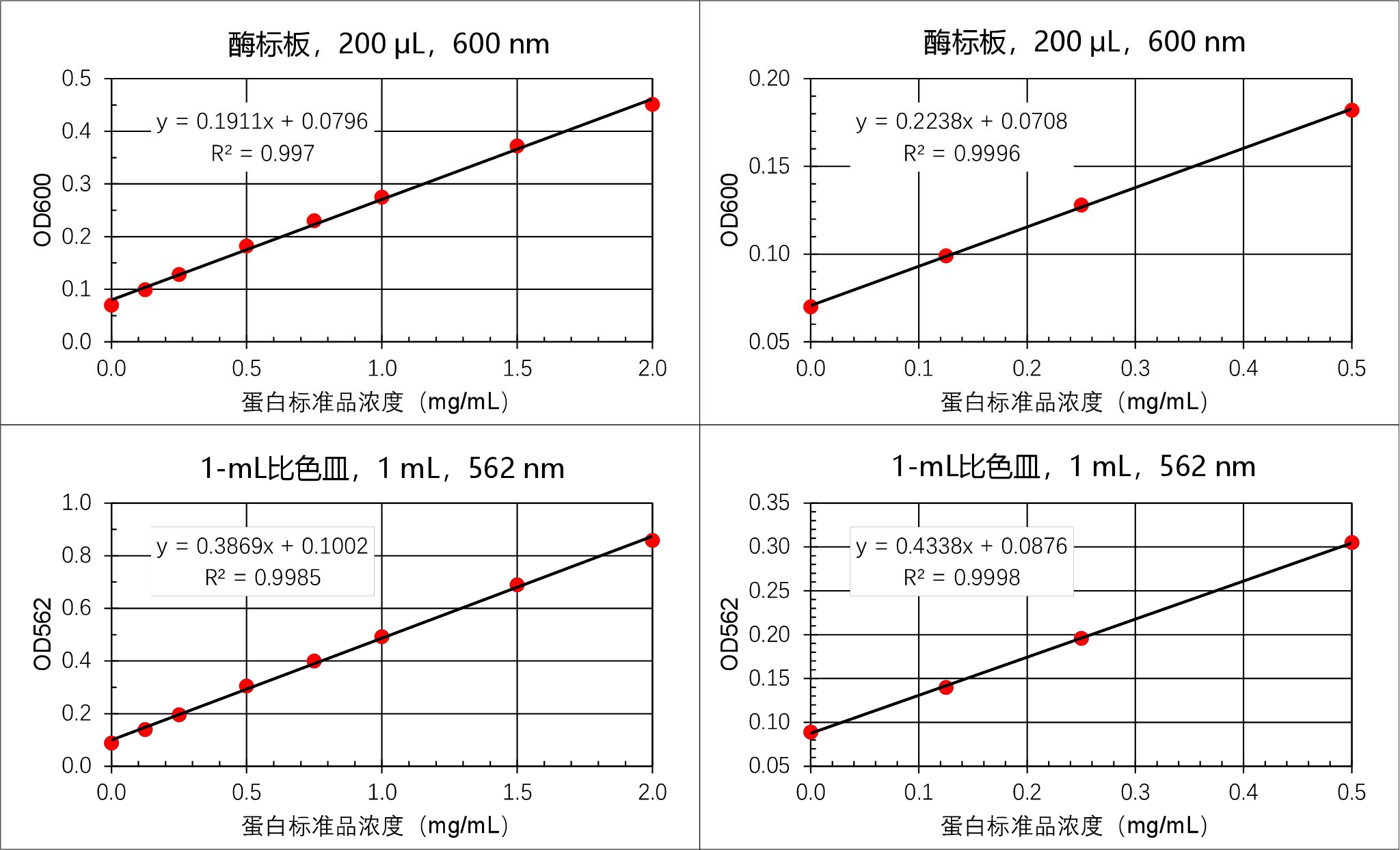
结果计算:
1. 用标准品的检测结果作标准曲线图,拟合直线:y = ax + b (a 和 b 分别为拟合直线 的斜率和截距,y 为标准品的 OD 值,x 为标准品的浓度)。
2. 蛋白浓度计算公式为 x’ = (y’ – b)/ a(y’ 为样本的 OD 值,x’ 为样本的蛋白浓度)。 即,样本中的蛋白浓度 = (样本的 OD 值 – 截距) ÷ 斜率
3. 最后,样本中的蛋白浓度(mg/mL)要用加入检测体系之前的稀释倍数进行校正。
标准曲线示例如下:
操作注意:
1. 标准曲线。本方法为非终止反应,检测信号随检测时的条件改变而变化,因此,标准 品需要与样本同时检测,标准曲线需要每次新做。在同样的检测条件下,比较样本与 标准品,才能得出正确的结果。拟合公式(y = ax + b)中,要注意得到的系数 a 和 b 有足够的有效数字(3-4 位有效数字),来保证计算的准确性。双喹啉甲酸法(BCA)比考马斯亮蓝法(Bradford)有明显更好的线性范围,但也同样有少许弯曲。为更好
地拟合,也可以用非线性方式拟合。
2. 样本液与工作液比值。工作液中的试剂是过量的,允许根据需要对样本液与工作液比 值进行调整,用不同的比值。如:酶标板微孔采用 1:10 的比值,比色皿采用 1:20 的 比值。关键是标准品和样本在同样的条件下测试、比较,才能得出正确的结果。样本 液的体积小时,优点是可以减小样本液中其他成分的干扰,但也要注意由于体积小, 在液体转移时可能增大的误差。
3. 检测波长。反应产物的光吸收峰值在 562 nm,因而在 562 nm 处检测有最高的信号 强度,最好的检测灵敏度。然而光吸收在峰值左右逐渐衰减,在其他波长处(如:595 nm 或 600 nm)检测时,虽然偏离了最佳条件,只要标准品和样本在同样的条件下 测试、比较,也能得出正确的结果。
4. 孵育温度与时长。这里的显色反应不是终止反应,而是显色在不断增强,与温度和时
长相关。温度越高,显色越快;时间越长,显色越深。因而孵育可以是 37℃/30 分钟,
也可以是室温/两小时,或 60℃/30 分钟。要注意检测时,光吸收不要超出酶标仪或
分光光度计的线性检测范围。
5. 检测范围。检测结果要根据与标准品的比较计算,要在标准品的浓度范围内。提供的
标准品浓度在 0.125-2 mg/mL,因而,检测范围在 0.125-2 mg/mL。如有需要检测
更低的浓度,可以将提供的标准品进一步稀释作为检测对照,用最佳的检测波长(562
nm)、较长的光径(1 cm)、较高的孵育温度(60℃)、和较长的孵育时间(60 分钟)
等手段,在更低的检测范围内检测,达到更高的检测灵敏度。
注意事项:
1. 样本中避免还原性物质,如:半胱氨酸(cysteine)、二硫苏糖醇(dithiothreitol, DTT)、 巯基乙醇(2-mercaptoethanol)、还原型谷胱甘肽(glutathione)、维生素 C(ascorbic acid)、等。
2. 样本中避免部分螯合剂,如:乙二醇二乙醚二胺四乙酸(EGTA)。
3. 对检测影响不大的物质:咪唑,50 mM;Tris,25 mM;PBS,50 mM;尿素,3 M; 盐酸胍,3 M;NaCl,1 M;EDTA,10 mM;乙醇,10%;蔗糖,40%; Triton X100, 5%;Tween-20,5%。(实验显示,除 5% SDS 外,都没有明显的影响).




